El dolor es un fenómeno que nos indica que alguna parte de nuestro cuerpo está sufriendo un daño. Se caracteriza por una respuesta de retirada del factor que lo está causando; por ejemplo quitar la mano de algo que quema, aunque en los humanos se puede conocer por verbalizaciones.
El dolor tiene una función protectora para nuestro organismo, como ocurre por ejemplo con el dolor proveniente de una inflamación. La inflamación suele acompañarse de daños en la piel y en los músculos.

Así, se intensifica en gran medida la sensibilidad de la parte inflamada a estímulos dolorosos; esto produce que se reduzcan los movimientos con la zona afectada y se evite el contacto con otros objetos. En definitiva, la misión de la inflamación es intentar disminuir la probabilidad de nuevas lesiones y acelerar el proceso de recuperación.
Aquellas personas que nacen con una sensibilidad al dolor reducida sufren más lesiones de lo normal, como quemaduras y cortes. También pueden adoptar posturas que son dañinas para las articulaciones, pero como no sienten dolor, no cambian de posición.
La ausencia de dolor puede tener consecuencias muy graves para la salud, e incluso puede conducir a la muerte. El análisis de la percepción del dolor es extremadamente complicado. No obstante, puede tratar de explicarse de forma simple.
El estímulo doloroso activa los receptores de dolor. Luego, la información se trasmite a los nervios especializados de la médula espinal para llegar finalmente al cerebro. Una vez procesado allí, este órgano envía un impulso que obliga al cuerpo a reaccionar. Por ejemplo, retirando rápidamente la mano de un objeto caliente.

La conciencia del dolor y la reacción emocional que este provoca se controla en el encéfalo. Los estímulos que tienden a producir dolor también ocasionan respuesta de retirada o huida. Subjetivamente, algo que produce dolor es molesto y perjudicial. Por eso lo evitamos activamente.
[toc]
Los tres elementos del dolor
Es cierto que algunos sucesos ambientales pueden modular la percepción del dolor. Por ejemplo, en un estudio de Beecher (1959) se analizó la respuesta al dolor de un grupo de soldados americanos que lucharon durante la Segunda Guerra Mundial.
Se demostró que gran parte de los soldados americanos que habían sufrido heridas en la batalla, no parecían mostrar signos de dolor. De hecho, no necesitaban medicación. Al parecer, la percepción del dolor se redujo en ellos al sentir el alivio de que habían logrado sobrevivir a la batalla.
También puede ocurrir que el dolor sí se perciba, pero no parece relevante para la persona. Algunos fármacos tranquilizantes ejercen este efecto, al igual que algunas lesiones en partes concretas del cerebro.
El dolor posee tres efectos distintos en la percepción y en el comportamiento.
– El aspecto sensorial. Se refiere a la percepción de la intensidad del estímulo doloroso.
– Las consecuencias emocionales directas que produce el dolor. Es decir, el grado de malestar que dicho dolor provoca en la persona. Este es el componente que disminuye en los soldados heridos que sobrevivieron a la batalla.
– La implicación emocional a largo plazo del dolor. Este efecto es producto de condiciones asociadas al dolor crónico. En concreto, se trata de la amenaza que supone este dolor para nuestro bienestar futuro.
Fisiología del dolor
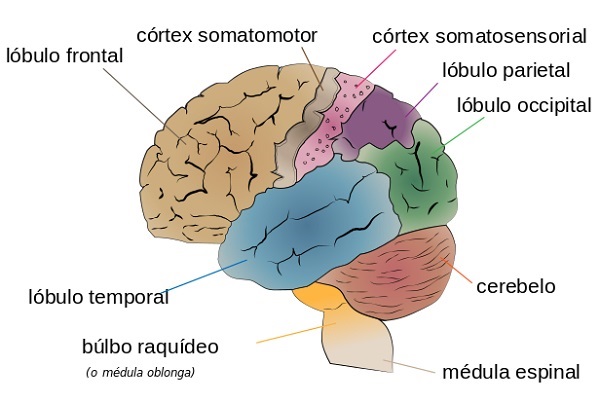
Los tres elementos anteriores implican a distintos procesos cerebrales. El componente puramente sensorial se regula en las vías que van desde la médula espinal hasta el núcleo ventral posterior del tálamo. Finalmente, llegan a la corteza somatosensorial primaria y secundaria del cerebro.
El componente emocional inmediato, parece controlarse por vías que llegan al córtex del cíngulo anterior y la ínsula. Se ha demostrado en diversos estudios que estas zonas se activan durante la percepción de estímulos dolorosos. Además, se ha comprobado que la estimulación eléctrica de la corteza insular provoca sensaciones de punzadas o de ardor en los sujetos.
En conclusión, la corteza somatosensorial primaria se encarga de percibir el dolor, mientras que la cingulada anterior procesa los efectos emocionales inmediatos. Por otro lado, el componente emocional a largo plazo está mediado por conexiones que llegan a la corteza prefrontal.
Las personas con daños en esta zona sienten apatía y tienden a no sentirse afectadas por las consecuencias de las enfermedades crónicas, abarcando el dolor crónico.
Tipos de receptores del dolor
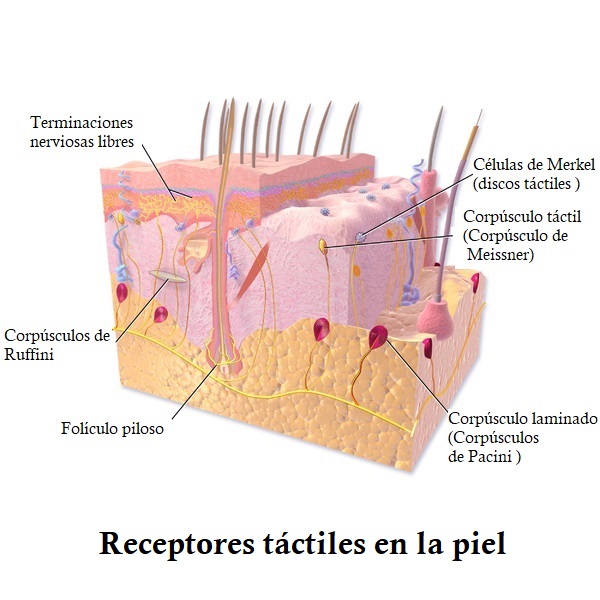
Los receptores del dolor son terminaciones nerviosas libres. Estos receptores están presentes en todo el cuerpo, especialmente en la piel, en la superficie de las articulaciones, en el periostio (membrana que recubre los huesos), las paredes de las arterias, y algunas estructuras del cráneo.
Resulta interesante que el cerebro en sí no tiene ningún receptor del dolor, por lo tanto, es insensible a est.
Los receptores del dolor responden a tres tipos de estímulos: mecánicos, térmicos y químicos. Un estímulo mecánico sería ejercer presión sobre la piel (por ejemplo). Mientras que un estímulo térmico, el calor o el frío. Un estímulo químico se trata de una sustancia exterior, como un ácido.
Los receptores del dolor también pueden estimularse por sustancias químicas presentes en el cuerpo. Se liberan como consecuencia de un trauma, inflamación u otros estímulos dolorosos. Ejemplo de esto es la serotonina, los iones de potasio o los ácidos como el láctico. Este último es el responsable del dolor muscular después de hacer ejercicio.
Existen tres tipos de receptores para el dolor, también llamados nociceptores o detectores de estímulos nocivos.
Mecanorreceptores de umbral elevado
Son terminaciones nerviosas libres que responden a presiones fuertes como un golpe u opresión en la piel.
Receptores VR1
El segundo tipo consiste en terminaciones nerviosas que captan los calores extremos, los ácidos y la capsaicina (principio activo del chile picante). Los receptores de este tipo de fibras son conocidos como VR1. Este receptor se ve implicado el dolor asociado a la inflamación y a las quemaduras.
De hecho, se demostró en un estudio que ratones que tenían una mutación contra la expresión de dicho receptor, podían beber agua con capsaicina. Ya que parecían insensibles a las altas temperaturas y al picante, aunque reaccionaban a otros estímulos dolorosos. Caterina et. al. (2000).
Receptores sensibles al ATP
El ATP es la fuente energética fundamental para los procesos metabólicos de las células. Esta sustancia se libera cuando la circulación sanguínea de una parte del cuerpo se interrumpe o cuando se lesiona un músculo. También se produce por los tumores de rápido desarrollo.
Por tanto, estos receptores pueden ser responsables del dolor vinculado con la migraña, la angina, las lesiones musculares o el cáncer.
Tipos de dolor
Los impulsos originados en los receptores del dolor son transmitidos a los nervios periféricos a través de dos fibras nerviosas: las fibras A delta, que se encargan del dolor rápido (primario), y las fibras C que trasmiten el dolor lento (secundario).
Cuando percibimos un estímulo doloroso tenemos dos sensaciones.
Dolor rápido
La primera de ellas es la de “dolor rápido”. Se experimenta como un dolor agudo, punzante y muy localizado. Esto activa mecanismos de protección como el reflejo de retirada.
Las fibras A delta que transmiten este tipo de dolor son microscópicamente más delgadas (de 2 a 5 milésimas de milímetro). Esto permite que el estímulo se trasmita más rápido (5 a 30 metros por segundo).
En el dolor rápido es localizado y no se extiende. Es difícil que se supere, incluso con analgésicos fuertes.
Dolor lento
Después de unos segundos sintiendo el dolor rápido, aparece el “dolor lento”. Es persistente, profundo, opaco y menos localizado.
Suele durar unos pocos días o semanas, aunque si el cuerpo no lo procesa apropiadamente, puede durar más y convertirse en crónico. Este tipo de dolor tiene como finalidad activar el proceso de reparación de tejidos.
Las fibras C que transmiten esta clase de dolor tienen un mayor diámetro que las fibras A delta (entre 0,2 y 1 milésima de milímetro). Por eso el impulso va más lento (velocidad de 2 metros por segundo). La respuesta del cuerpo es mantener inmóvil la parte afectada, dando lugar a espasmos o rigidez.
En el dolor lento son muy eficaces los opioides, aunque también lo son los anestésicos locales si se bloquean los nervios apropiados.
¿Por qué se produce la analgesia?
Cuando los seres vivos tienen que afrontar algún estímulo perjudicial, suelen interrumpir lo que estén haciendo para iniciar conductas de retirada o escape. No obstante, hay momentos en los que esta reacción es contraproducente. Por ejemplo, si un animal tiene una herida que provoca dolor, las respuestas de huida pueden interferir con las actividades diarias, como comer.
Por ello, sería más conveniente que el dolor crónico se pudiera reducir. La analgesia también sirve para disminuir el dolor durante la ejecución de conductas biológicamente importantes.
Ejemplo del apareamiento
Algunos ejemplos son la lucha o el apareamiento. Si en estos momentos se experimentara dolor, estaría en peligro la supervivencia de la especie.
Por ejemplo, algunos estudios han demostrado que copular puede generar analgesia. Esto tiene un significado adaptativo, ya que los estímulos dolorosos durante la cópula se sentirían en menor medida para que la conducta reproductora no se interrumpa. Esto incrementa la probabilidad de reproducción.
Ratas
Se ha demostrado que cuando las ratas reciben descargas eléctricas dolorosas que no pueden evitar, experimentaban analgesia. Es decir, tenían menos sensibilidad al dolor que los sujetos controles. Esto se produce por la liberación de opioides que dicta el propio organismo.
En definitiva, si se capta que el dolor es inevitable, se activan mecanismos analgésicos. Mientras que, si es evitable, se motiva al sujeto a dar las respuestas convenientes para interrumpir ese dolor.
Formas de evitar dolor físico
El dolor puede reducirse si se estimulan zonas diferentes a las afectadas. Por ejemplo, cuando una persona tiene una herida siente cierto alivio si se rasca alrededor.
Por eso la acupuntura utiliza agujas que se insertan y se giran para estimular terminaciones nerviosas cercanas y lejanas de aquellas en las que se reduce el dolor.
Algunos estudios han probado que la acupuntura produce analgesia debido a la liberación de opioides endógenos. Aunque la disminución del dolor puede ser más efectiva si la persona “cree” en sus efectos, esta no es la única razón.
Hay estudios realizados con animales que han demostrado una reducción de la sensibilidad del dolor. Así como la activación de proteínas Fos en las neuronas somatosensoriales del asta dorsal de la médula espinal.
Referencias
- Basbaum, A. I., Bautista, D. M., Scherrer, G., & Julius, D. (2009). Cellular and molecular mechanisms of pain. Cell, 139(2), 267-284.
- Beecher, H. K. (1959). Measurement of subjective responses: quantitative effects of drugs. New York: Oxford University Press.
- Carlson, N.R. (2006). Fisiología de la conducta 8ª Ed. Madrid: Pearson.
- Mayer, D. J., & Liebeskind, J. C. (1974). Pain reduction by focal electrical stimulation of the brain: an anatomical and behavioral analysis. Brain research, 68(1), 73-93.
- National Research Council (US) (2010). Recognition and alleviation of pain in laboratory animals. Washington (DC): National Academies Press (US).
- Rainville, P., Duncan, G. H., Price, D. D., Carrier, B., & Bushnell, M. C. (1997). Pain affect encoded in human anterior cingulate but not somatosensory cortex. Science, 277(5328), 968-971.
- Stucky, C. L., Gold, M. S., & Zhang, X. (2001). Mechanisms of pain. Proceedings of the National Academy of Sciences, 98(21), 11845-11846.