Explicamos en qué consiste la reacción de Maillard, sus etapas, efectos y aplicaciones.

¿Qué es la reacción de Maillard?
La reacción de Maillard, también conocida como glucosilación no enzimática, es un fenómeno químico en el que los azúcares reductores reaccionan con los grupos aminos de las proteínas, sin la participación de ninguna enzima. Esta reacción procede a bajas temperaturas, pero alcanza su máxima rapidez cuando los reactivos se calientan en un intervalo entre 140-165 ºC.
Cuando cocinamos, el uso del horno o del aceite asegura que la temperatura sea óptima para el desarrollo de la reacción de Maillard, pues los alimentos contienen azúcares y proteínas sensibles a reaccionar entre sí. Por lo tanto, esta reacción tiene lugar en todos los ámbitos de la gastronomía donde el calor o el fuego doren o tuesten los alimentos.
La reacción de Maillard es muy compleja y hasta la fecha no se ha podido describir con entera exactitud. Está sujeta a varios parámetros, tales como la composición de los alimentos, la temperatura, el pH, el tiempo de calentamiento, etc., cada uno teniendo peso en los sabores y olores finales a los que normalmente estamos habituados.
Aunque muchas de sus aplicaciones se reserven a la cocina, lo cierto es que transcurre también dentro del organismo, siendo de interés para estudios médicos dirigidos a problemas cardiovasculares y de la diabetes.
Etapas de la reacción de Maillard
La reacción de Maillard es un conglomerado de muchas reacciones, las cuales terminan generando cientos de productos, que en su mayoría ni siquiera han sido caracterizados.
Sin embargo, hay tres etapas en la que puede dividirse esta reacción y son: formación de la base de Schiff, formación del producto de Amadori, y las reacciones de este producto.
Formación de la base de Schiff
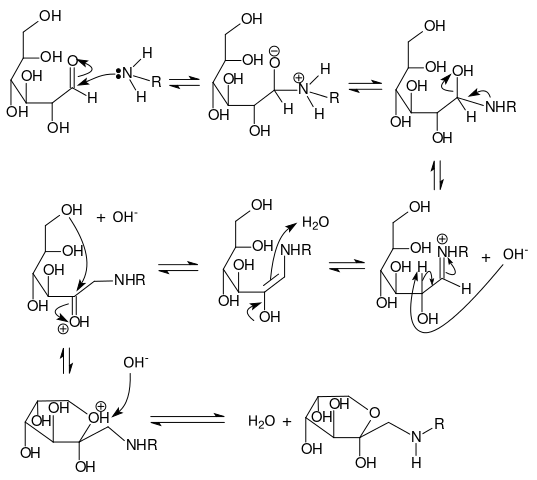
En primer lugar, el grupo carbonilo del azúcar reductor debe ser atacado nucleofílicamente por el átomo de nitrógeno de un grupo amino (ver primera fila de la imagen superior). Este grupo amino pertenece a cualquiera de los aminoácidos localizados en la superficie de la proteína, accesibles para que reaccione con el azúcar reductor más cercano.
Nótese que las dobles flechas indican que se trata de una reacción reversible. Cuando el azúcar reductor se une al grupo amino, se forma lo que se conoce como una glucosamina. La glucosamina reordena sus cargas eléctricas hasta originar la base de Schiff (segunda fila, cuarta estructura).
Formación del producto de Amadori
La base de Schiff, con su átomo de nitrógeno cargado positivamente y rodeada de un ion OH–, se reacomoda para reducir su inestabilidad. En el proceso, se transforma en el compuesto 1,2-enaminol (estructura del centro), el cual a su vez reacomoda su estructura para dar lugar a un anillo, correspondiente a la molécula del producto de Amadori, la cual también puede existir como una cadena abierta (última fila y las tres últimas estructuras).
Reacciones del producto de Amadori
A partir del producto de Amadori, cíclico o lineal, pueden desencadenarse distintas reacciones. Es aquí donde la reacción de Maillard se torna complicada.
Por un lado, este producto puede deshidratarse o fragmentarse para formar compuestos dicarbonílicos, los cuales también reaccionan con los grupos aminos de otras proteínas y originan otros compuestos no del todo caracterizados. Entre algunos de estos productos tenemos el hidroximetilfurfural (HMF), el piruvaldehído, o las reductonas.
La predominancia relativa de estos productos depende del pH. Por ejemplo, el HMF se forma en condiciones ácidas, que es cuando añadimos zumo de limón o ingredientes ácidos a los alimentos mientras se cocinan. En cambio, las reductonas predominan en condiciones básicas, que es cuando se utiliza el polvo de hornear.
Los productos anteriores, derivados del producto de Amadori, pueden sufrir condensación aldólica para ensamblar polímeros conocidos como melanoidinas. Las melanoidinas son las responsables de las coloraciones doradas, marrones o pardas (según sus pesos moleculares promedio) que vemos en los alimentos cocinados.
Asimismo, durante esta etapa se desprenden moléculas pequeñas y aromáticas, como las furanonas (olor a caramelo), tiofenos (olor a carne chamuscada), pirroles (olor a nueces y cereales), entre otras tantas.
Efectos de la reacción de Maillard
En la comida
La reacción de Maillard, en toda su complejidad, tiene efectos sensoriales relativamente simples: el dorado o tostado de los alimentos, y el desprendimiento de aromas. Hablamos de sabores y olores.
Es por eso que esta reacción, aunque no pueda describirse, sí puede manipularse de tal modo que se obtengan los sabores y olores deseados para un platillo en específico.
En el organismo
La reacción de Maillard puede proceder a temperatura ambiente, o dentro del mismo organismo. Solamente cambia la rapidez del proceso. Las proteínas y los azúcares reductores reaccionan reversiblemente, y finalmente, luego del producto de Amadori, las reacciones prosiguen de manera irreversible.
El impacto que tiene esta reacción en el organismo depende de cómo funcionan las proteínas una vez tengan los azúcares enlazados a ellas, y de los efectos beneficiosos o tóxicos de los productos reversibles o irreversibles. Algunos de estos productos, como la carboximetil-lisina, están asociados a la diabetes y problemas cardiovasculares.
Otros productos, como la acrilamida, se les consideran inclusive carcinógenos, y la industria de los alimentos busca por lo tanto reducir al mínimo la formación de la acrilamida durante la reacción de Maillard.
No obstante, también se ha hallado productos con propiedades bactericidas, antioxidantes y antialérgicas, que aumentan además las actividades de las enzimas.
Aplicaciones de la reacción de Maillard

Los productos de la reacción de Maillard se disfrutan en los siguientes alimentos o productos:
- Cervezas
- Café, por el tueste de los granos,
- Pollo, en las superficies doradas y pardas de sus piezas a la brasa o freídas,
- Carnes de reses, en los olores y colores de sus filetes
- Panes, en sus costras o bordes marrones
- Galletas y tortas, en sus tonalidades marrones
- Papitas fritas
- Palomitas de maíz
- Tocinetas
- Pescados
- Cebollas
La reacción de Maillard puede confundirse con la reacción de caramelización. Esta última transcurre a mayor temperatura, y su mecanismo se debe a la pirolisis de los azúcares, y no a una reacción entre azúcares reductores y proteínas.
Referencias
- Graham Solomons T.W., Craig B. Fryhle. (2011). Organic Chemistry. (10th edition.). Wiley Plus.
- Carey F. (2008). Química Orgánica. (Sexta edición). Mc Graw Hill.
- Morrison y Boyd. (1987). Química orgánica. (Quinta edición). Addison-Wesley Iberoamericana.
- Wikipedia. (2021). Maillard reaction. Recuperado de: en.wikipedia.org
- Compound Interest. (27 de enero de 2015). Food Chemistry: The Maillard Reaction. Recuperado de: compoundchem.com
- Eric Schulze. (13 de abril de 2017). An Introduction to the Maillard Reaction: The Science of Browning, Aroma, and Flavor. Recuperado de: seriouseats.com